Ein Forschungsteam der Rice University hat kürzlich einen technologischen Fortschritt beim Aufbau funktionaler Protein-Nanostrukturen erzielt. Das Team entwickelte ein zweistufiges Genregulationssystem, das darauf abzielt, komplexe Nanostrukturen in technischen Zellen effizienter und nachhaltiger zu produzieren. Die entsprechenden Forschungsergebnisse wurden in der Fachzeitschrift „Nature Communications“ veröffentlicht.
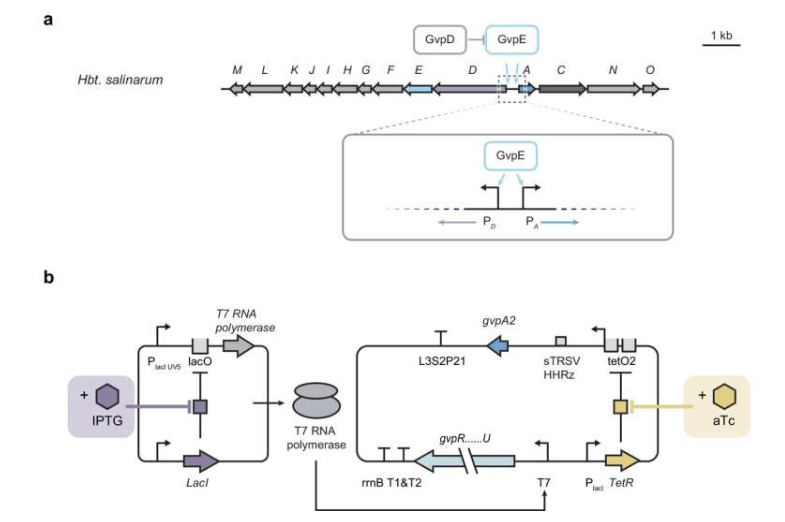
Diese Arbeit wurde von George Lu, Assistenzprofessor an der Abteilung für Bioengineering der Rice University, geleitet. Die Forschung konzentrierte sich auf Gasvesikel – hohle, zylindrische Protein-Nanostrukturen, die von Mikroorganismen produziert werden. Diese Strukturen werden aufgrund ihrer einzigartigen akustischen Eigenschaften als vielversprechende Nanowerkzeuge in den Bereichen biomedizinische Sensorik, Bildgebung und Therapie angesehen.
Die Produktion solcher komplexen, aus mehreren Proteinen bestehenden Strukturen im Labor mit Hilfe von technischen Bakterien (wie E. coli) stellt jedoch eine Herausforderung dar. Die gleichzeitige Expression mehrerer relevanter Gene setzt die Wirtszellen unter erheblichen Stress, beeinträchtigt ihr Überleben und limitiert die Ausbeute der Zielstrukturen. Prof. Lu erklärte: „Forschungsergebnisse der letzten Jahre haben gezeigt, dass die Fähigkeit von Gasvesikeln, Schall zu reflektieren, sie zu einem einzigartigen und vielseitigen akustischen Reportersystem für die biomedizinische Forschung und klinische Anwendungen macht. Aber wir haben ein neues Genregulationssystem entwickelt, das sicherstellt, dass die Wirtszellen gesund bleiben und gleichzeitig funktionale Nanostrukturen produzieren können.“
Um dieses Problem zu lösen, entwarf das Forschungsteam eine zweistufige Strategie. Der Kern dieser Strategie liegt in der präzisen Kontrolle des Zeitpunkts und des Niveaus der Expression der verschiedenen Proteinkomponenten. Konkret induzierten sie zunächst die Expression der für den Strukturaufbau verantwortlichen „Faktor“-Proteine. Sobald diese bereit waren, wurde die Expression der die Vesikel-Hauptstruktur bildenden „Hüll“-Proteine gestartet.
Zongru Li, ein ehemaliger Doktorand aus Prof. Lus Labor und Hauptbeteiligter an der Studie, erläuterte das Prinzip: „Indem man die Assemblierungsfaktoren zwei bis drei Stunden vor der Induktion der Hüllproteine arbeiten lässt, kann man sicherstellen, dass die zellulären Mechanismen für den Strukturaufbau bereits vorhanden sind, bevor die Hauptstrukturproteine eingeführt werden.“ Diese Methode veränderte den Proteinexpressionsmodus von simultan zu sequentiell und reduzierte effektiv den Zellstress.
Prof. Lu fasste zusammen: „Durch die Umstellung der Produktionsweise von simultan auf sequentiell verwandelt dieses Genregulationssystem einen chaotischen Assemblierungsprozess in einen geordneten Produktionsablauf. Das Ergebnis sind gesündere Wirtsorganismen und eine höhere Gasvesikel-Ausbeute. Dieser Ansatz bietet eine robuste und zuverlässige Methode zur Vesikelproduktion für klinische und Forschungsanwendungen und kann auch für die Produktion anderer mehrkomponentiger Proteinkomplexe genutzt werden.“ Diese Technologie zur Genregulation und Synthese von Protein-Nanostrukturen eröffnet neue Perspektiven für das zukünftige Design und die Produktion komplexerer Bio-Nanomaterialien.
Publikationsdetails: Autoren: Zongru Li et al., Titel: „Temporal gene regulation enables controlled gas vesicle expression and sustains bacterial viability“, erschienen in: „Nature Communications“ (2025). Zeitschrifteninfo: „Nature Communications“