Ein Forschungsteam der Universität Glasgow hat kürzlich einen bedeutenden Durchbruch erzielt: Es setzte erstmals ein bioengineered Knochenmarkmodell erfolgreich in der Krebsforschung ein und lieferte so neue Erkenntnisse zu potenziellen Therapien für akute myeloische Leukämie (AML). Die in der Fachzeitschrift *Biomaterials* unter dem Titel „Synthetic peptide hydrogels as a model of the bone marrow microenvironment demonstrate the efficacy of CRISPR-CAR T-cell combination therapy in acute myeloid leukemia“ veröffentlichte Studie markiert einen entscheidenden Fortschritt in der tierversuchsfreien medizinischen Forschung.
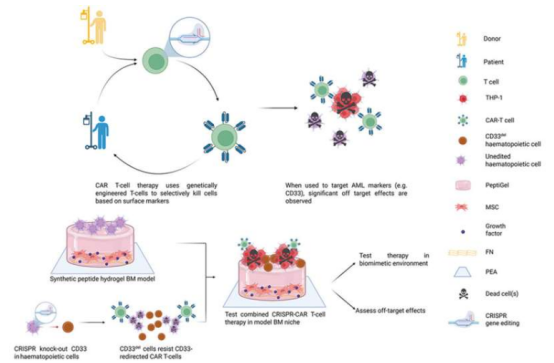
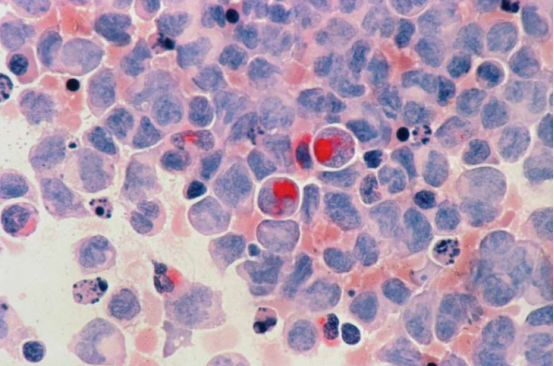
Leukämie entsteht durch Mutationen in hämatopoetischen Stammzellen (HSCs), deren Wachstum und Überleben stark von der Knochenmark-Mikroumgebung abhängen. Traditionelle In-vitro-Studien stehen jedoch vor großen Herausforderungen: Nach der Ablösung vom Knochenmark verändern sich hämatopoetische Stammzellen rasch morphologisch oder funktionell oder sterben sogar ab, was die Manipulation im Labor extrem erschwert. Bisher konnten Forschungsteams neue Medikamente nur anhand von Tiermodellen testen, doch die Unterschiede zwischen tierischen und menschlichen physiologischen Mechanismen schränkten die Übertragbarkeit der Ergebnisse auf den Menschen ein. Um diese Herausforderung zu bewältigen, entwickelte das Team der Universität Glasgow ein innovatives, bioartifizielles Knochenmarkmodell. Dabei wurden leukämiebedingte hämatopoetische Stammzellen in ein Hydrogel implantiert, das die natürliche Knochenmarkumgebung simuliert. So konnte die Stabilität der Stammzellen erfolgreich erhalten und die Grundlage für weitere Forschung geschaffen werden.
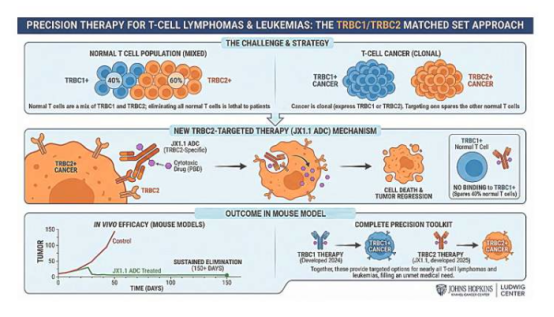
Mithilfe dieses Modells testete das Forschungsteam erstmals die Wirksamkeit der CAR-T-Zelltherapie bei akuter myeloischer Leukämie (AML) im Labor. Obwohl die CAR-T-Therapie bei anderen Blutkrebsarten vielversprechend ist, bleibt ihre Anwendung bei AML aufgrund ihrer Toxizität für gesunde Zellen begrenzt. Die Forscher schlugen daher vor, die CRISPR-Cas9-Geneditierungstechnologie mit der CAR-T-Therapie zu kombinieren, um durch das „Verbergen“ gesunder Zellen potenziell eine präzise Zielsteuerung zu ermöglichen. Aufgrund von Unterschieden zwischen menschlichen und tierischen Modellen gestaltete sich die Validierung der Wirksamkeit dieser kombinierten Therapie jedoch schwierig. Mithilfe bioartifizieller Modelle entdeckte das Team, dass traditionelle Petrischalenexperimente die Wirksamkeit der CAR-T-Therapie nicht nur überschätzten, sondern auch deren potenziellen Schaden für gesunde Zellen nicht vorhersagten – Probleme, die in bioartifiziellen Gewebemodellen deutlich sichtbar wurden.
Diese Entdeckung ist ein Meilenstein für präklinische Testmethoden der CAR-T-Zelltherapie. Dr. Hannah Donnelly, Forscherin an der Universität Glasgow und eine der Hauptautorinnen der Studie, erklärte: „Herkömmliche Testmethoden weisen eine erhebliche Übertragungslücke auf, was zu hohen Abbruchraten in klinischen Studien, steigenden Kosten und Verzögerungen in der Patientenbehandlung führt. Durch die Kombination menschlicher Zellen mit Hydrogelen zur Simulation der Knochenmarksstruktur können wir die Wirksamkeit der Therapie und unerwünschte Nebenwirkungen bereits im Laborstadium deutlich früher beurteilen – weit vor den kostspieligen klinischen Studien.“ Sie betonte außerdem, dass tierversuchsfreie Technologien einen effizienteren Weg für die Entwicklung von Leukämietherapien bieten, die Abhängigkeit von Tiermodellen potenziell verringern und die Entwicklung sicherer und wirksamer Behandlungen beschleunigen können.
Weitere Informationen: W. Sebastian Doherty-Boyd et al., „Synthetische Peptidhydrogele als Knochenmark-Mikroumgebungsmodell demonstrieren die Wirksamkeit der CRISPR-CAR-T-Zell-Kombinationstherapie bei akuter myeloischer Leukämie“, *Biomaterials* (2026). Zeitschrifteninformationen: *Biomaterials*